SPORT E PROTIDES em parceria com a ATLET
Recapitular'
As proteínas constituem uma família química heterogênea e são consideradas biomoléculas de primordial importância:
Quantitativamente, as proteínas representam 55 a 85% do peso seco. Eles são o segundo elemento mais comum no corpo depois da água.
Qualitativamente, eles têm um papel estrutural, mas também um papel funcional vital.
Exceto em casos excepcionais (jejum prolongado, reservas insuficientes de glicogênio, etc.), as proteínas não contribuem significativamente para suprir as necessidades energéticas.
Nossas necessidades são muito importantes em termos de proteínas. Nossa organização fabrica cerca de 100 tipos diferentes!
Todas as proteínas são construídas a partir de 20 aminoácidos diferentes.
Entre eles, 8 são aminoácidos essenciais (EAA): o corpo humano não sabe como fabricá-los. A comida deve, portanto, fornecê-los e, mais ainda, na mesma refeição. Porque, se para produzir uma de suas proteínas, o corpo carece de apenas um desses 8 EAAs, a produção da proteína para, o corpo não sabe como deixar de lado os outros 7 enquanto espera o 8º chegar.
As proteínas animais fornecem todos esses 8 EAAs, o que não é o caso das proteínas vegetais, que são deficientes em um dos 8 EAAs. Os vegetarianos devem, portanto, comer na mesma refeição cereais (trigo, milho, arroz, etc.) com baixo teor de lisina e leguminosas (lentilhas, grão de bico, etc.) com baixo teor de metionina.
A síntese de proteínas é essencial para o desenvolvimento, crescimento, mas também para a manutenção da massa corporal. Se os carboidratos representam a fonte essencial de fornecimento de energia, o exercício regular aumenta significativamente as necessidades diárias de compostos nitrogenados. Sob condições muito específicas, é provável que certos aminoácidos sejam oxidados para constituir substratos energéticos por si só. No entanto, todas as proteínas presentes no corpo desempenham um papel funcional específico, e não há aminoácidos armazenados e armazenados como carboidratos ou lipídios. Se necessário, são, portanto, os aminoácidos derivados de proteínas estruturais ou funcionais que serão utilizados, o que provavelmente afetará o funcionamento do organismo.
Assim, na ausência de ingestão de proteínas, o corpo se auto-canibaliza e se auto-digere!
A ausência de proteínas obriga o corpo a retirá-las das suas “reservas”: a fusão dos músculos (incluindo o coração) e depois das vísceras (intestinais, fígado, etc.) é então inevitável!
Aproveitar as reservas leva a deficiências: as defesas imunológicas enfraquecem, a digestão e o trânsito diminuem, a cicatrização é ruim, a pele envelhece...
Como é frequente, as variações registadas no metabolismo das proteínas estão intimamente ligadas ao tipo de desporto praticado, e os problemas colocados serão muito diferentes consoante a modalidade desportiva considerada seja a resistência ou a força-potência. No entanto, na faixa muito ampla que vai de exercícios de curta e muito alta intensidade (exercício anaeróbico do tipo explosivo) a exercícios de longa duração do tipo duradouro, as respostas do metabolismo protéico são qualitativamente semelhantes, associando uma queda na síntese protéica e aumento da degradação durante a atividade e o inverso durante a recuperação...
Lembretes das aulas de bioquímica…
As proteínas constituem uma família química heterogênea e são consideradas biomoléculas de primordial importância:
- quantitativamente, as proteínas representam 55 a 85% do peso seco. Eles são o segundo elemento mais comum no corpo depois da água.
- qualitativamente, eles têm um papel estrutural, mas também um papel funcional vital.
Exceto em casos excepcionais (jejum prolongado, diabetes, etc.), as proteínas não contribuem significativamente para suprir as necessidades energéticas.
Eles têm um papel de suporte mecânico e suporte tecidual, por exemplo colágeno, a proteína mais abundante no corpo; no nível celular, as proteínas do citoesqueleto (actina, tubulina) são responsáveis pela forma da célula.
Eles têm um papel de catalisador bioquímico, caso das enzimas sem as quais quase todas as reações químicas seriam impossíveis no organismo; papel de transportador de sangue, albumina (que é a proteína plasmática mais importante, contribui para o transporte de ácidos graxos livres ou certas vitaminas) ou hemoglobina (localizada nas células vermelhas do sangue, permite o transporte de oxigênio e dióxido de carbono); papel de transportador de membrana, as proteínas controlam quantitativa e qualitativamente as trocas entre a célula e o meio extracelular, os transportadores específicos de glicose; papel de mediador químico como hormônios peptídicos, como insulina e glucagon; papel do receptor de membrana; papel na manutenção da integridade do corpo, imunoglobulinas (anticorpos); papel do movimento, as proteínas contráteis dos músculos (actina e miosina).
As proteínas são compostos orgânicos compostos de carbono (C), hidrogênio (H), oxigênio (O) e nitrogênio (N) aos quais às vezes é adicionado enxofre (S). Sua estrutura monomérica é aminoácido. Dependendo da importância da polimerização e da composição, é possível distinguir vários tipos de proteínas:
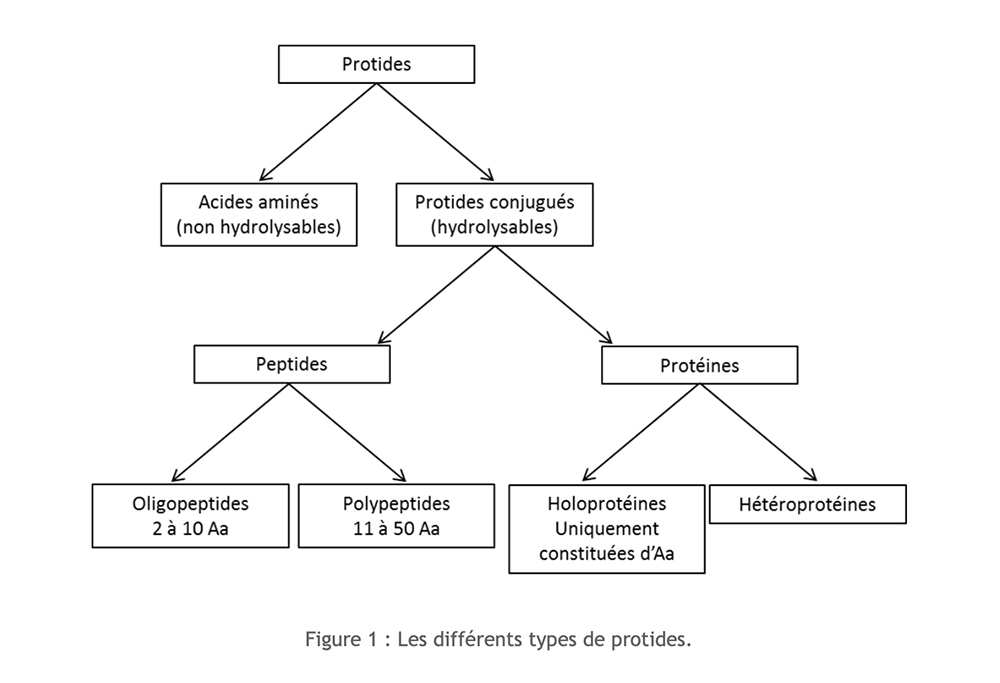
Aminoácidos
Os aminoácidos têm uma estrutura molecular comum. São compostos nitrogenados.
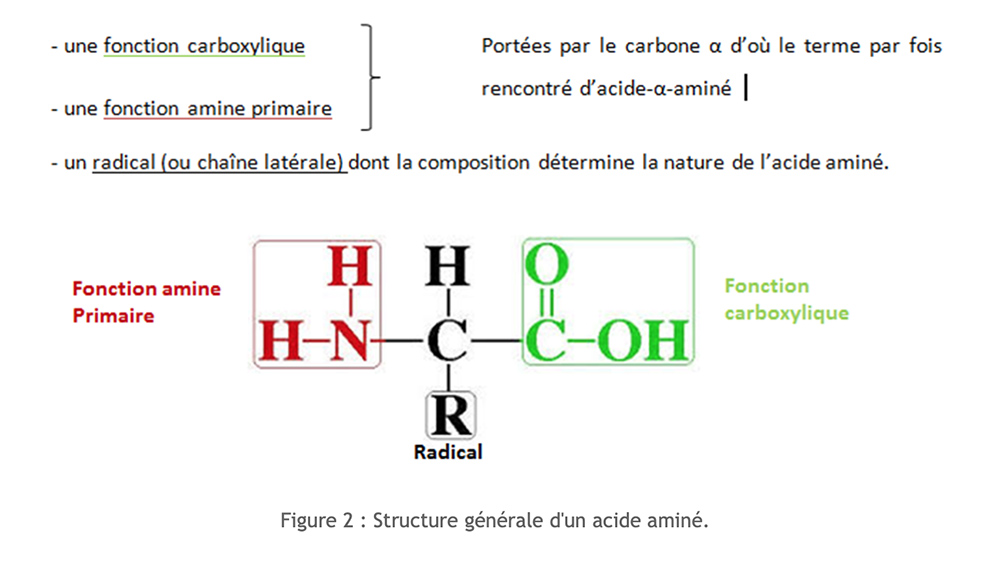
Mais de 250 aminoácidos diferentes estão listados. No entanto, todas as nossas proteínas são feitas de um grupo de 20 aminoácidos, que são chamados deaminoácidos padrão.
Podemos classificar esses aminoácidos de acordo com a natureza de sua cadeia lateral. Para facilitar a escrita dos aminoácidos, utiliza-se um código de três letras ou um código com uma letra.
Os diferentes aminoácidos
Podemos listar oito aminoácidos essenciais em adultos (Val, Leu, Ile, Thr, Met, Lys, Phe e Trp) mais um nono em crianças (His). Esses aminoácidos devem obrigatoriamente estar presentes na dieta.
- glicínia (Gli ou G).
- alanina (Ala ou A), aminoácido muito comum em proteínas.
- o Vale (Val ou V).
- Leucina (Leu ou L) e isoleucina (Ile ou I) que não podem ser sintetizados pelo organismo, portanto fazem parte dos aminoácidos essenciais.
- Serina (Sor ou S).
- Treonina (Thr ou T), que é um aminoácido essencial.
- cisteína (Cys ou C) contribui para a estabilização da estrutura terciária das proteínas graças à formação de pontes dissulfureto. A cisteína também é o precursor da taurina.
- Metionina (Met ou M) que faz parte dos aminoácidos essenciais.
- Ácido aspártico (Asp ou D) e oácido glutâmico (Glu ou E). Esses aminoácidos são muito comuns em proteínas. Como aminoácidos livres, eles desempenham um papel importante no metabolismo do nitrogênio. O ácido glutâmico também serve como precursor para a formação do ácido γ-aminobutírico (GABA), um mediador do sistema nervoso central.
- asparagina (Asn ou N) e glutamina (Gln ou Q); eles têm um papel importante no metabolismo do nitrogênio.
- Lisina (Lys ou K) é um dos aminoácidos essenciais (encontra-se em particular no colagénio).
- L'arginine (Arg ou R) desempenha um papel importante no ciclo da uréia e participa da formação da creatina.
- Histidina (His ou H) é considerado um aminoácido essencial em crianças.
- Fenilalanina (Phe ou F) é um dos aminoácidos essenciais. Como o próprio nome sugere, sua estrutura é a de alanina substituída por um grupo fenil, formando um radical hidrofóbico. Sua hidroxilação dá tirosina (Tyr ou Y). Esses dois aminoácidos são importantes porque servem como precursores para a biossíntese de catecolaminas (sendo as mais comuns adrenalina, noradrenalina e dopamina). Tirosina participa da formação dos hormônios tireoidianos.
- Triptofano (Trp ou W) é um aminoácido essencial. É um precursor biossintético da serotonina e da vitamina B3.
- Prolina (Pro ou P). Assim como a lisina, tem a particularidade de ser hidroxilado dentro do colágeno: a hidroxiprolina.
Os peptídeos
Peptídeos resultam da associação de aminoácidos. A ligação resulta da condensação entre a função carboxílica (do carbono α) de um aminoácido e a função amina (do carbono α) de um segundo aminoácido. Essa condensação é acompanhada pela liberação de uma molécula de água.
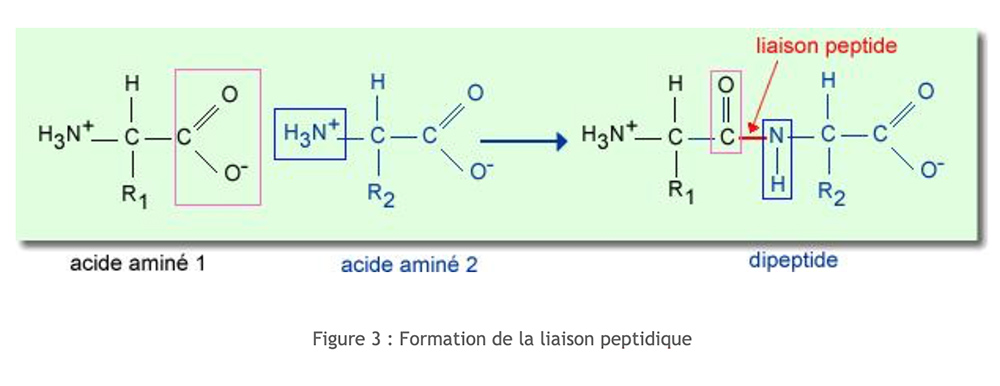
Este arranjo eletrônico induz uma ligação peptídica rígida e planar. Como resultado, não há rotação entre C e N, o que influencia consideravelmente a estrutura secundária de peptídeos e proteínas.
Exemplos de peptídeos de interesse biológico
- Glutationa: Este tripéptido desempenha um papel importante a nível celular, neutralizando os radicais livres, especialmente nos glóbulos vermelhos. Sua sequência é: γGlu-Cys-Gly.
- DHA: Este peptídeo é sintetizado pelo hipotálamo através de seus neurônios neurossecretores. Liberado ao nível da hipófise posterior no sangue, tem um papel hormonal: estimula a reabsorção de água pelo rim.
Ingestão de proteínas e exercícios
Hoje, está cientificamente demonstrado que o metabolismo das proteínas é afetado pela prática de exercícios. No entanto, muitas vezes damos a eles um papel muito grande; A realidade nutricional é mais medida.
A síntese de proteínas é essencial para o desenvolvimento, crescimento, mas também para a manutenção da massa corporal. A prática regular de desporto aumenta significativamente as necessidades diárias de compostos azotados e, em particular, em condições muito específicas (depleção das reservas de glicogénio, queda acentuada do açúcar no sangue, etc.). No entanto, não armazenamos aminoácidos. Se necessário, são, portanto, os aminoácidos derivados de proteínas estruturais ou funcionais que serão utilizados, o que provavelmente afetará o funcionamento do organismo.
Esportes de resistência: Oxidação de aminoácidos e necessidades de proteínas
Se a necessidade de proteínas representa a quantidade ideal de proteínas necessária para garantir toda a síntese proteica do organismo, para compensar a oxidação dos aminoácidos e as perdas relativas devido à aceleração do turnover das proteínas, podemos facilmente concluir que a repetição de exercícios de resistência induz um aumento nas exigências nutricionais de proteínas e aminoácidos. O exercício a longo prazo induz mudanças significativas no metabolismo das proteínas. Estudos experimentais mostram que esse tipo de prática de resistência está associada a uma redução drástica nos processos de síntese proteica muscular. Portanto, no contexto de exercício prolongado, se a oferta de glicose for insuficiente, há um aumento da degradação proteica com o objetivo de aumentar a disponibilidade de aminoácidos que podem contribuir para a gliconeogênese ou entrar no ciclo de Krebs para fornecer energia no organismo. forma de ATP. finalmente, o recuperação deste tipo de exercício exigirá a consideração ingestão de proteína direcionada.
Os aminoácidos disponíveis em nosso corpo têm várias origens: derivam da ingestão alimentar, resultam de proteólise endógena ou são sintetizados de novo no corpo (para aminoácidos não essenciais). A disponibilidade de aminoácidos essenciais depende apenas da ingestão alimentar e do seu nível de degradação.
Excluindo o exercício, há um equilíbrio perfeito entre a degradação (proteólise) e a síntese de proteínas (proteossíntese).
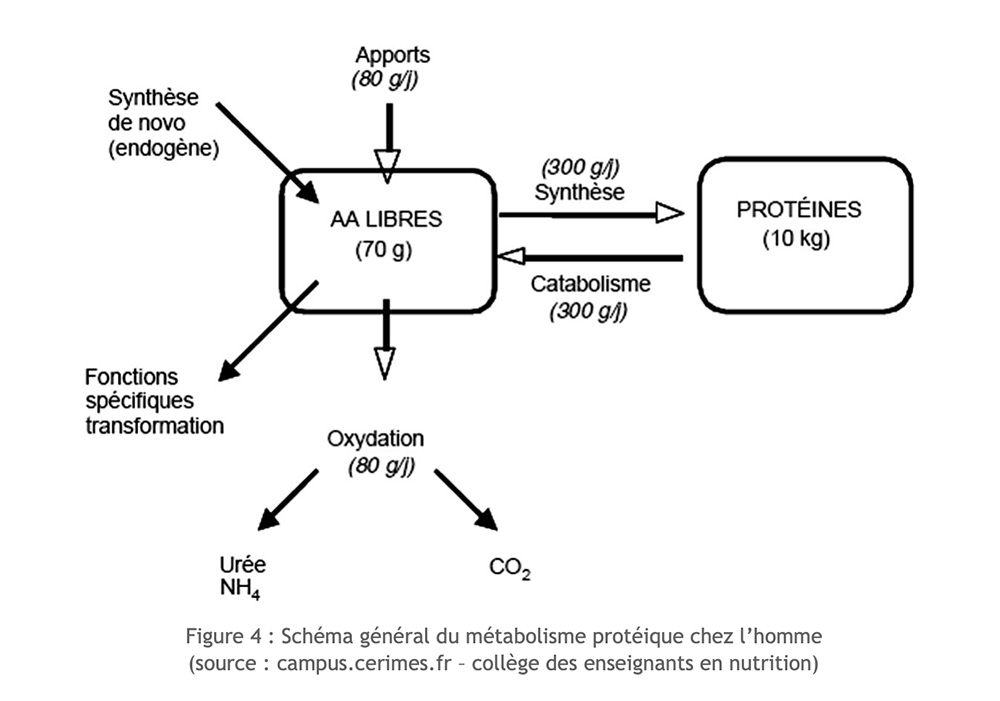
Mas no contexto do exercício de longo prazo, a ingestão de nitrogênio é reduzida, a síntese de proteínas não pode compensar sua degradação e atrofia da massa muscular. Certos aminoácidos podem então ser considerados como substratos realmente úteis para o funcionamento muscular. Eles são usados oxidativamente. No entanto, apenas alguns aminoácidos podem ser oxidados diretamente no músculo esquelético: estes são essencialmente aminoácidos ramificados ou ramificados (AAB: leucina, isoleucina, valina) e muito mais incidentalmente aspartato, asparagina e prolina.
As proteínas da nossa dieta
A proteína dos alimentos nunca entra diretamente em nossos tecidos. Deve ser “degradado” em aminoácidos ou dipeptídeos. Uma vez terminada a fase de digestão, os aminoácidos ingeridos através da nossa alimentação são indistinguíveis daqueles resultantes da degradação das proteínas do corpo. Para desenvolver as suas próprias proteínas, o nosso corpo vai tirar do “saco comum” onde se encontram todos os aminoácidos disponíveis (os da alimentação e os resultantes da destruição das proteínas do corpo), no tempo “t”. . Em uma situação ideal, nossa ração deve fornecer níveis ótimos de aminoácidos, em particular os oito essenciais.
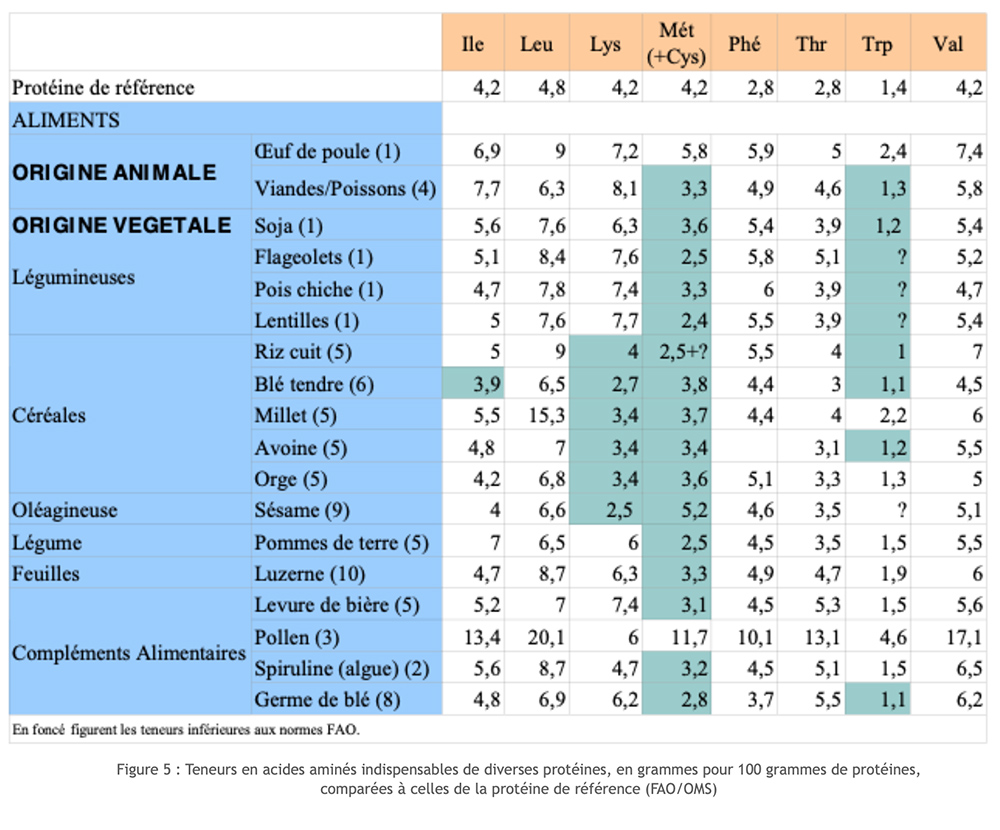
As fontes animais de proteína pontuam muito bem nas escalas de Valor Biológico (BV) e Coeficiente de Utilização Digestiva (DUC). Isso é diferente para proteínas vegetais. De fato, sejam cereais ou leguminosas, descobrimos que alguns dos aminoácidos essenciais são fornecidos apenas em níveis muito baixos (fator limitante). Os cereais geralmente carecem de lisina; leguminosas e soja têm o fator limitante metionina. Acoplando as duas fontes, conseguimos reconstituir um conjunto completo de AA essenciais, mas com um certo desperdício! Além disso, se esta escolha permite prevenir deficiências graves e crônicas de um AA essencial, não garante o correto andamento de todos os metabolismos envolvendo a participação de aminoácidos a longo prazo. Esta insatisfação funcional encontra-se em particular com a síntese de neurotransmissores, particularmente a da serotonina que depende do triptofano, aminoácidos muitas vezes limitantes.
Soma-se a isso o problema ligado aos sistemas de absorção de aminoácidos. Estes entram nas células através de proteínas receptoras nas membranas celulares. Existem 4 famílias de receptores para 20 aminoácidos. De fato, fenômenos de competição acontecem. Assim, não é suficiente fornecer um aminoácido na taxa correta para garantir que os processos resultantes ocorram corretamente. Aminoácidos concorrentes não devem ser encontrados em uma taxa muito alta, o que dificultaria a assimilação dos primeiros.
A composição de aminoácidos brutos de uma refeição não nos permite deduzir até que ponto o fornecimento de diferentes aminoácidos será fornecido de maneira ideal a cada uma de nossas células.
Quando você come proteína, você incorpora nitrogênio em seu corpo. Quando procedemos à diferença dos dois (entrada menos saída) obtemos o que se chama de “balanço de nitrogênio”. Um balanço nitrogenado positivo é registrado quando a ingestão de nitrogênio excede a soma das excreções urinárias, fecais e sudoríparas. Um balanço de nitrogênio positivo é necessário para garantir um nível adequado de síntese. É neste método de análise que se definem as RNP (Recomendações Nutricionais para a População), que se referem a uma noção essencialmente quantitativa de necessidades, e cumprem os objetivos de prevenir deficiências e não afetar a síntese proteica.
As recomendações para os entusiastas dos esportes de resistência são consensuais: 1,2 a 1,5 g/kg/dia.
Assim, para uma pessoa de 70 kg, a recomendação de ingestão proteica fica entre: 84g/dia a 105g/dia; isso equivale, por exemplo, a grandes quantidades de carne: de 465 a 580 g! Daí o interesse de consumir outras fontes de proteína (cereais, leguminosas, etc.), ou concentrados direcionados para a recuperação precoce. Mais uma vez, recomenda-se adotar uma alimentação diária variada e equilibrada, adaptada ao nível de treino.
Nos atletas, as necessidades relacionadas com a renovação funcional são aumentadas, em determinadas condições, devido ao catabolismo das proteínas, que afecta sobretudo os elementos contrácteis do músculo (especialmente nos corredores, devido à onda de choque que exerce um efeito destrutivo ao repetir si mesmo cada vez que o pé pressiona o chão). Esses processos aumentam as perdas e se somam aos que correspondem ao uso energético de determinados aminoácidos. Como resultado, uma perda do nível plasmático da maioria dos aminoácidos e um aumento na excreção urinária de nitrogênio podem ser observados após um teste de pedestres de 100 km.
Mas cuidado, o aumento do uso de suplementos de proteína “não direcionados” pode aumentar significativamente as necessidades; de fato, a taxa de síntese é fixada pela disponibilidade do aminoácido menos presente nos tecidos. Isso significa que se os aminoácidos ramificados tiverem seu nível diminuído em resposta ao exercício, as sínteses realizadas no pós-esforço serão proporcionais às quantidades restantes de leucina, isoleucina e valina.
Certos aminoácidos atuam como moléculas capazes de estimular a síntese de proteínas. A leucina é capaz de estimular especificamente a síntese de proteínas nos músculos e no fígado, mesmo sob condições desfavoráveis (Cf.: Buse MG, Reid M (1975): Leucina, um possível regulador da renovação de proteínas no músculo. J Clin. Invest., 58 : 1250).
A ingestão de suplementos proteicos ricos em aminoácidos ramificados permite, portanto, evitar o desgaste muscular, bem como a deterioração de um certo número de parâmetros físicos, psicológicos e fisiológicos (Cf.: Degoutte F, Jouanel P & Coll (2006): Food restrição e desempenho, alterações bioquímicas, psicológicas e endócrinas em atletas de judô.Int. J. Sport Med., 27 (1): 9 – 18.).
Além dos aminoácidos ramificados, outros dois parecem-nos que não devem ser negligenciados na ração do atleta:
Metionina (fator limitante para leguminosas e soja):
A presença de metionina (Met) em um nível ótimo condiciona o progresso de um grande número de reações que também são condicionadas pelo nível de ingestão de energia. De fato, como vimos acima, Met pode contribuir para fornecer energia aos tecidos em uma situação de emergência. Isso é feito através do ciclo de Krebs às custas de outras intervenções metabólicas de Met. Portanto, qualquer diminuição na ingestão dietética de Met leva a uma desaceleração dessas diferentes vias, em particular a da gliconeogênese, e isso, para manter seu nível mínimo nas células. Além disso, a transformação de Met em cisteína para promover a formação de glutationa (participando da cascata anti-radical), é retardada em favor do fornecimento de energia, ou não pode ocorrer.
Glutamina, Glicina e Aspartato:
Nosso capital energético é baseado na molécula de DNA que tem a forma de uma dupla hélice (dupla fita). O RNA, por outro lado, é um polímero de fita simples semelhante ao DNA. O DNA armazena informações genéticas na célula, enquanto o RNA é usado para transmitir informações de codificação fora do núcleo da célula e, em seguida, sintetizar proteínas a partir dessas informações. As bases que compõem o RNA são fornecidas em pequenas quantidades pelos alimentos, a maior parte na verdade vem de sínteses realizadas nas células. Estes são feitos de aminoácidos, alguns dos quais estão disponíveis apenas em quantidades limitadas. O capital genético e as proteínas são, portanto, intimamente dependentes. Os precursores são: glutamina, glicina e aspartato. A glutamina é ainda mais envolvida, pois contém 2 moléculas de nitrogênio. A sua disponibilidade é, portanto, crucial em situações em que a multiplicação celular rápida é essencial (resposta imunológica, cicatrização, etc.). Aqui, a presença de cofatores enzimáticos como zinco, vitaminas B9, B12 (apenas de origem animal) e B6 revela-se decisiva para o bom andamento do processo de síntese.
Portanto, qualquer déficit ou desequilíbrio na ingestão desses aminoácidos, e em particular da glutamina, afetará a recuperação, a resposta à atividade.
Esses diferentes pontos tornam muito complexo definir uma ingestão proteica ideal/ótima. A recomendação, vista acima, leva em consideração possíveis distúrbios funcionais para adequar as capturas tanto quantitativa quanto qualitativamente, na diversidade. Os suplementos constituem apenas pequenos reajustes da ração e consistem em peptídeos altamente digeríveis e direcionados. Não devem, em caso algum, compensar deficiências nutricionais comprovadas. Por vezes considerados supérfluos, parece no entanto que são acompanhados por uma melhoria do estado de saúde do atleta em causa.
Artigo escrito para nosso parceiro Atlet por:
Caroline JOUCLA • Nutricionista-dietista certificada pelo Estado • www.carolinejoucladieteticienne.com
